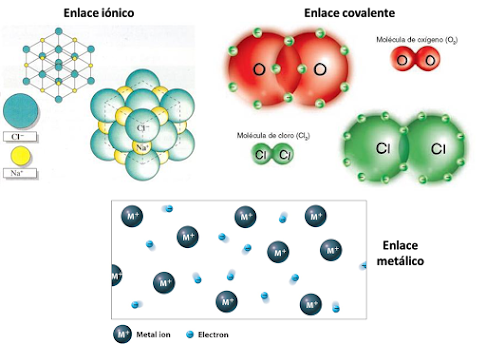
Enlace Covalente
Es una fuerza que uno dos átomos de elementos no metálicos para formar una molécula. Compartiendo electrones pertenecientes a su capa de valencia o ultimo nivel de energía, alcanzando gracias a ellos el conocido "regla del octeto" propuesto por Gilbert Newton Lewis sobre la estabilidad electrónica de los átomos.
Características de los enlaces covalentes
- Los enlaces covalentes son mas estables cuando son no polares, es decir, cuando la electronegatividad de los átomos es similar.
- Solo se forman entre elementos no metálicos ( Oxígenos, Hidrogeno, Nitrógeno, etc.).
- Los electrones se comparten siempre en pares, bien sea en enlaces simples, dobles (cuatro electrones) o triples (seis electrones).
Tipos de enlaces covalentes
Existen los siguientes tipos de enlace covalente, a partir de la cantidad de electrones compartidos por los átomos enlazados:
- Simple: Los átomos enlazados comparten un par de electrones de su ultima capa electrónica. Se representan por una linea en el compuesto molecular. Por ejemplo: H-Cl (Hidrogeno -Cloro).
- Doble: Los átomos enlazados aporta cada uno dos electrones de su ultima capa de energía. Se representa líneas paralelas, una arriba y una abajo. Por ejemplo: O=C=O (Oxigeno-Carbono-Oxigeno).
- Triple: En este enlace se forma por tres partes de electrones, es decir, cada átomo aporta 3 electrones de su ultima capa de energía. Por ejemplo: N≡N (Nitrógeno≡ Nitrógeno).